Calendario Científico 2019 - Abril
La lucha contra el paludismo empieza en el diagnóstico
¿Cómo puede la detección directa automatizada de eritrocitos (RBC) infectados por paludismo contribuir a la lucha global contra la enfermedad?
Puede siempre descartarse el paludismo si una prueba de diagnóstico rápido de malaria (PDR) de alta sensibilidad es negativa
Si no se observan eritrocitos infectados por paludismo en un análisis microscópico somero de un frotis de sangre periférica de un paciente con fiebre, se puede considerar que la causa de la fiebre no sea originalmente el paludismo
La tecnología automática XN-31 permite una cuantificación rápida, fiable y precisa de los eritrocitos infectados por paludismo, con lo que se facilita el seguimiento de la disminución de la carga parasitaria y, por consiguiente, el de la eficacia terapéutica una vez el tratamiento con fármacos contra el paludismo haya sido iniciado
Las PDR para paludismo pueden utilizarse de forma eficaz para supervisar la respuesta a los fármacos contra esta enfermedad
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Fundamentación científica
El paludismo sigue siendo uno de los principales caballos de batalla en términos de salud pública a nivel global, ya que más de 3.2 mil millones de personas se encuentran en riesgo de infección en 91 países [1]. El informe mundial sobre el paludismo de la OMS de 2017 señalaba que, tras un periodo destacado de éxitos en el control global del paludismo, el número de casos se había incrementado una vez más, habiéndose estancado el progreso en ese sentido. Se hace necesario el máximo esfuerzo para invertir esta tendencia ya que, cada caso de paludismo que se previene y cada muerte que se evita contribuyen al impulso global hacia su eliminación.
El diagnóstico temprano y preciso es un aspecto fundamental en el marco de los esfuerzos para controlar el paludismo. La recomendación de la OMS es que se realice un análisis parasitológico en todos los casos en que se sospeche de paludismo, bien al microscopio, bien mediante una PDR, y con el fin de evitar el inicio de tratamientos preventivos que se basen sólo en sospechas clínicas, reduciendo así la exposición innecesaria a los fármacos contra el paludismo.
La evaluación al microscopio de un frotis de sangre periférica permite visualizar directamente los parásitos en eritrocitos infectados, y es en la actualidad la referencia en cuanto al diagnóstico. No obstante, es una prueba demasiado subjetiva, ya que el límite de detección está muy determinado por la habilidad y la diligencia del microscopista. Por tanto, las infecciones de baja densidad por paludismo a nivel submicroscópico pasan sin ser detectadas en la práctica habitual y de forma normal, siendo las mujeres embarazadas las más afectadas, y de una forma desproporcionada. A ello se añade el hecho de que el paludismo no diagnosticado en el embarazo comporta un riesgo elevado de mortalidad tanto para la madre como para el feto.
Por otra parte, las pruebas de diagnóstico rápido (PDR) inmunocromatográficas son fáciles de usar y de distribuir como pruebas autónomas o en combinación con el microscopio. Las PDR se basan en la detección indirecta del paludismo a través de la presencia sus proteínas o de antígenos contra la enfermedad [2]. No obstante, presentan varios inconvenientes: no son capaces de distinguir entre la infección aguda o la que ha sido tratada recientemente; no son cuantitativas, por lo que no sirven para controlar la eficacia del tratamiento; no todas las PDR pueden detectar todas las especies de Plasmodium; y no son demasiado específicas (carecen el reactividad cruzada con otros antígenos, como el factor reumatoide) ni sensibles (en comparación con el análisis microscópico en manos de un experto). Ante la perspectiva de que aumente la proporción de infecciones de baja densidad a medida que el control del paludismo evoluciona positivamente, y los países se encaminan hacia su eliminación, se han desarrollado pruebas PDR de alta sensibilidad con la proteína 2 rica en histidina (HRP2) de P. falciparum como antígeno diana. Desafortunadamente, la ventaja que se preveía en cuanto al aumento de la sensibilidad ha quedado atenuado por el descubrimiento de mutaciones de la HRP2 en el P. falciparum, el parásito del paludismo más común y el más mortal. Por consiguiente, cualquier PDR basada en HRP2 reducirá su eficacia con la difusión de este tipo de mutaciones.
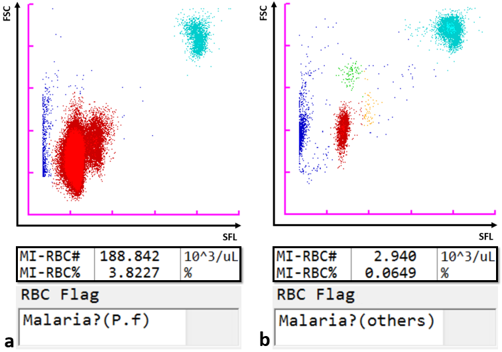
Gracias a su láser de semiconductor con haz de 405 nm, que permite detectar partículas más pequeñas, el analizador automático para hematología XN-31 de Sysmex permite detectar y contar eritrocitos infectados por paludismo (MI-RBC), sumándolo a los parámetros normalizados para hemograma completo (CBC) que se basan en el principio de citometría de flujo por fluorescencia. Los eritrocitos adquieren cierta permeabilidad, lo que hace posible que absorban un marcador para fluorescencia que tiñe los ácidos nucleicos del parásito del paludismo en el seno de las células infectadas. La intensidad de la luz de fluorescencia lateral (SFL) y de la señal de la luz de dispersión frontal (FSC) se trazan para generar un diagrama de dispersión de la malaria (M). El tamaño del eritrocito infectado y el contenido en ácido nucleico teñible aumentan a medida que se desarrollan formas en anillo de manera secuencial, de trofozoítos y esquizontes durante el periodo asexual del ciclo de vida. De forma similar, los gametocitos, que se forman después de un momento de activación del desarrollo hacia la reproducción sexual, pueden identificarse de forma singular. Por tanto, el XN-31 clasifica la infección por malaria en una muestra en función de las etapas del ciclo de vida del parásito basándose el reflejo de la cantidad de ácido nucleico por la SFL y en el tamaño de los MI-RBC reflejado por la FSC. Los patrones del diagrama de dispersión varían dependiendo de la especie de Plasmodium, y el software del analizador lo aprovecha para apuntar hacia la probabilidad de que se trate de una u otra especie (P. falciparum u otra).
El límite inferior de detección del analizador se sitúa en 20 parásitos/μL, referencia muy por debajo de las que son posibles con las PDR habituales o con el análisis microscópico de frotis de rutina (≥ 100 parásitos/μL [3]).
El analizador XN-31 supone un método ideal para el reconocimiento preciso y la enumeración automática rápida en la parasitemia por malaria, sin que interfiera la habilidad del operador ni la especie afectada. Detecta al propio parásito y no a ningún subproducto, ya se trate de antígenos, hemozoína o parásitos fagocitados insertos en leucocitos, por lo que resulta más adecuado para detectar la malaria si se compara con las PDR u otros métodos automáticos indirectos [4]. Asimismo, la medición simultánea del hemograma completo es una característica diferencial que proporciona información valiosa para el establecimiento de correlaciones clínicas.
Diagramas de dispersión
Bibliografía
- WHO. World malaria report 2018. Geneva: World Health Organization; 2018. www.who.int/malaria/publications/world-malaria-report-2018/en/.
- Chotivanich K, Silamut K, Day N. Laboratory diagnosis of malaria infection ‒ A short review of methods. N Z J Med Lab Sci. 2007; 61:4-7.
- WHO. Policy brief on malaria diagnostics in low transmission settings. Geneva: World Health Organisation; 2014. www.who.int/malaria/publications/atoz/malaria-diagnosis-low-transmission-settings-sep2014.pdf
- Pillay E, Khodaiji S, Bezuidenhout BC, Litshie M, Coetzer TL. Evaluation of automated malaria diagnosis using the Sysmex XN-30 analyser in a clinical setting. Malar J. 2019; Jan 22; 18(1):15. doi: 10.1186/s12936-019-2655-8.