Calendario científico septiembre de 2023
Identificación de una LLC típica mediante dos tecnologías complementarias
¿Cómo es posible identificar linfocitos anómalos con técnicas distintas?
A través de su contenido de ARN/ADN en los canales WDF y WPC de la Serie XN.
Detectando un fenotipo linfocítico anómalo gracias al inmunofenotipado por citometría de flujo.
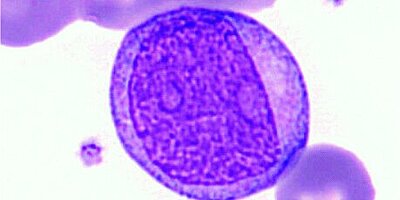
Tomando como base rasgos morfológicos como ratio NC elevada, núcleo oval y cromatina nuclear heterogénea agregada.
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Fundamentación científica
La leucemia linfocítica crónica (LLC) es un tipo de linfoma maligno. La OMS clasifica la LLC como neoplasia de células B maduras; afecta sobre todo a la sangre periférica, a la médula ósea y también los ganglios linfáticos, el hígado y el bazo [1]. Con una incidencia de entre 2 y 6 casos por cada 100 000 personas al año en el mundo occidental [2] es la forma de leucemia más común en adultos, así como el tipo más prevalente, como consecuencia de una supervivencia de los pacientes relativamente prolongada [3,4].
El aspecto predominantemente monomórfico de los linfocitos apunta a menudo a la existencia de una población de células neoplásicas clónicas. Como se observa en una LLC típica, los linfocitos anómalos suelen ser células pequeñas con aspecto de maduras y con baja actividad mitótica [1].
Con la excepción de los linfocitos citolíticos naturales (las células NK), no es posible establecer con fiabilidad la estirpe de los linfocitos mediante tinción de Pappenheim, ya que solo pueden llevarse a cabo un número de observaciones morfológicas limitado. Para determinar con fiabilidad la presencia de linfocitos es necesario realizar un inmunofenotipado. Los linfocitos anómalos en la LLC expresan los antígenos de superficie CD19, CD20, CD5, CD23, CD43 y CD200, con expresión de cadenas ligeras kappa o lambda [5]. El antígeno CD10 da resultado negativo.
Información general sobre el caso
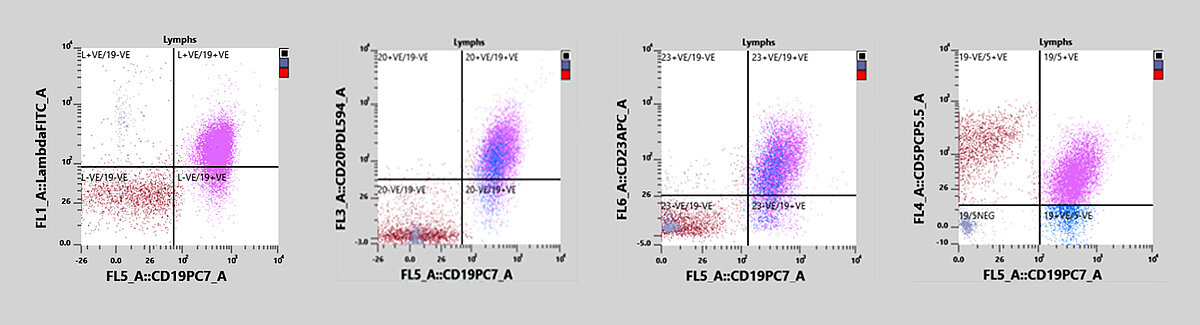
Paciente que acudió al médico generalista por sentirse mal. Se le extrajo una muestra de sangre periférica que se envió al laboratorio. Un análisis inicial con un XN-20 mostró un recuento PLT normal y ausencia de anemia, pero reveló linfocitosis con presencia de células potencialmente malignas. El médico envió la muestra al laboratorio de citometría de flujo para su análisis mediante inmunofenotipificación. La muestra se midió en un analizador XF-1600, dio positivo para CD19, CD5, CD20, CD23, CD79b y mostró la presencia de una proliferación monoclonal de cadenas ligeras lambda.
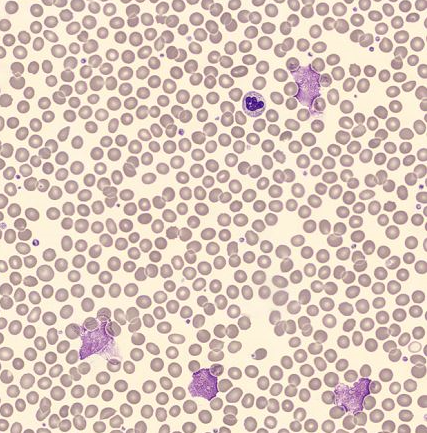
Asimismo, se realizó un frotis de sangre que se analizó con el analizador automático de imagen digital DI-60. El frotis reveló la presencia de linfocitos pequeños con elevada relación núcleo/citoplasma y patrón nuclear de cromatina condensada. También pudieron encontrarse sombras nucleares (o células rotas), que son un elemento habitual en pacientes con leucemia linfocítica crónica [6].
Interpretación del diagrama de dispersión y la morfología
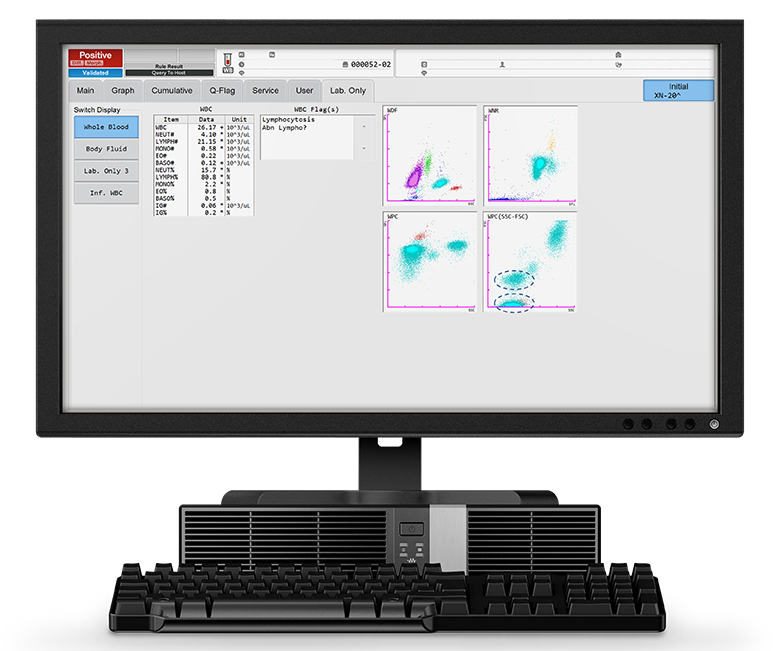
El análisis de la sangre del paciente reveló un aumento acusado del recuento de leucocitos de 26,17 x103/µL, de los que el 80 % eran linfocitos (Lymph# 21,15 x103/µL). Esto es visible en el diagrama de dispersión WDF, en el que la población linfocitaria aparece en forma de nube de gran densidad.
Los reactivos usados en el canal WPC tienen un efecto de lisis más potente sobre las membranas leucocitarias que los del canal WDF, lo que conduce a una mayor permeabilidad celular. El marcador fluorescente específico usado en el canal WPC marca el ADN del núcleo de las células. Cuanto mayor es el grado de permeabilización, mayor cantidad de marcador fluorescente puede penetrar en la célula y fijarse en el ADN, lo que genera una señal fluorescente intensa. Los linfocitos neoplásicos, que son más maduros, tienen membranas fácilmente permeables por el elevado contenido en lípidos de las membranas celulares, lo que genera una señal fluorescente intensa. Esto puede verse en el diagrama de dispersión WPC de la Figura 1: la población de linfocitos neoplásicos forma una agrupación de puntos rojos en la zona de alta fluorescencia del diagrama. La vista SSC-FSC del diagrama de dispersión WPC muestra dos poblaciones de linfocitos diferenciadas (círculos azules).
El análisis morfológico con un analizador de imágenes digitales DI-60 reveló la presencia de sombras nucleares (o células rotas).
Interpretación de los resultados de la inmunofenotipificación
Se realizó un lavado previo de la muestra antes de la tinción para excluir inmunoglobulina foránea en el plasma, pues podría afectar a los resultados finales. A continuación se aplicó un protocolo de lisis/lavado. En resumen:
- Se introdujo un cóctel de anticuerpos dentro de un tubo de poliestireno de 75 mm x 12 mm.
- Se dividió en partes alícuotas 100 µl de la muestra lavada en el mismo tubo y se mezcló mediante vórtex a 2.500 rpm durante 5 segundos.
- La mezcla se incubó durante 15 minutos en condiciones de oscuridad a temperatura ambiente.
- Se introdujeron en el tubo 2 mL de una solución de 1 parte de soluto en 10 partes de disolvente CyLyse FX para hacer la lisis de los eritrocitos y fijar los leucocitos, mezclando mediante vórtex a 2.500 rpm durante 5 segundos.
- La mezcla se incubó durante 10 minutos en condiciones de oscuridad a temperatura ambiente.
- A continuación se lavó la muestra dos veces con PBS, y se pasó al XF-1600 para la obtención de datos.
Se producen interacciones anticuerpo/antígeno en la muestra y la mezcla de anticuerpos, de manera que los anticuerpos monoclonales se adhieren al antígeno diana específico de la superficie celular. Cada anticuerpo monoclonal tiene una marca fluorescente detectable por el citómetro de flujo, lo que permite al usuario distinguir entre positivos y negativos y realizar por tanto el diagnóstico.
CyLyse FX es una solución con base de formaldehído que produce la lisis de los eritrocitos y fija los leucocitos con el anticuerpo y la marca vinculada. Sin la lisis, el citómetro incluiría también los eritrocitos en el proceso, y no son relevantes para este tipo de prueba.
Por último, la muestra se lava para evitar la inclusión de los restos de eritrocitos en la generación de datos y que el usuario pueda disponer de una imagen más clara durante la captación de la muestra, asegurándose así un análisis preciso de los datos.
En este caso, la inmunofenotipificación reveló linfocitosis y una tenue población con doble positivo para CD19/CD5. Asimismo se observó una proliferación monoclonal de la cadena lambda ligera. En la muestra se expresaban también los antígenos CD20, CD23 y CD79b, y fue negativa sin embargo para CD10, CD11c y CD38, todo lo cual apunta al diagnóstico de una LLC-B.
Bibliografía
[1] WHO (2017): Classification of Tumours of Haematopoietic and Lymphoid Tissues. Revised 4th Edition, Volume 2
[2] Rozman C et al. (1995): Chronic lymphocytic leukemia. N Engl J Med. 333(16): 1052-1057.
[3] Lanasa MC et al. (2010): Novel insights into the biology of CLL. Hematology Am Soc Hematol Educ Program. 2010:70-6.
[4] NIH National Cancer Institute (1975-2007): SEER Cancer Statistics Review.
[5] Rawstron AC et al. (2017): Reproducible diagnosis of chronic lymphocytic leukemia by flow cytometry: An European Research Initiative on CLL (ERIC) & European Society for Clinical Cell Analysis (ESCCA) Harmonisation project. Cytometry B Clin Cytom. 94(1): 121-128.
[6] Marionneaux SM et al. (2021): Smudge Cells in Chronic Lymphocytic Leukemia: Pathophysiology, Laboratory Considerations, and Clinical Significance. Lab Med. 52(5): 426-438.
White paper

The white blood cell differential (WDF) channel utilises fluorescence markers that can separate different WBC subtypes according to their cell membrane composition and cytoplasmic content