Calendario científico, agosto de 2023
Control preciso del tratamiento de la hemofilia
¿Qué reactivo no debería utilizarse para el control del tratamiento con Esperoct?
No hay ninguna limitación para la elección del reactivo para el ensayo de coagulación de una etapa basado en el tiempo de tromboplastina parcial activada (APTT). Para el control del tratamiento con Esperoct se puede utilizar cualquier reactivo, tanto basado en sílice, como en ácido elágico o en caolín.
Con la mayoría de los reactivos de APTT basados en sílice cabe la posibilidad de que se subestime la concentración de Esperoct infundido. Por consiguiente, la elección del reactivo de APTT depende del producto específico.
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Antecedentes
Si bien la hemofilia como tal se conoce desde hace siglos y la han descrito muchos autores, la historia de su tratamiento eficaz es relativamente reciente. Las primeras opciones de tratamiento se limitaban al tratamiento agudo de la hemorragia presente mediante la administración de donaciones de sangre entera procedentes de familiares y, tras el descubrimiento de los agentes de coagulación, la administración de transfusiones de plasma. No obstante, este tipo de tratamiento no impedía las hemorragias. Esto solo cambiaría a partir de los años 60, cuando Judith G. Pool descubrió que los crioprecipitados de plasma contienen cantidades importantes de factor VIII (FVIII). Aunque en los primeros años esos crioprecipitados siguieron utilizándose para el tratamiento de la hemorragia existente, su descubrimiento sentó las bases del tratamiento preventivo que se lograría por primera vez cuando se desarrollaron los concentrados de factor VIII recombinante, en la segunda mitad de los años 80. [1, 2]
En los últimos años, el desarrollo de preparados para el tratamiento de la hemofilia ha conocido un nuevo impulso. Han aparecido opciones de tratamiento con nuevos productos recombinantes dotados de una semivida más larga, basados en la modificación del factor de coagulación correspondiente, en la modificación del factor de coagulación mediante la fusión de la región Oc de la inmunoglobulina IgG1 (-Oc) o albúmina, o la adición de macrogol (PEG) con diferentes pesos moleculares. [3] No obstante, también están cada vez más presentes las estrategias terapéuticas que no apuntan al tratamiento mediante sustitución del factor. Emicizumab, por ejemplo, es un anticuerpo monoclonal humanizado modificado preconfigurado para el tratamiento de la hemofilia A (HA). Una parte del anticuerpo se une al factor de coagulación IX activado (FIXa) y la otra al el factor de coagulación X (FX). De este modo imita la función del factor VIII activado (FVIIIa), ausente o reducido en pacientes con HA. [4] Otra opción de tratamiento para los pacientes con hemofilia es la terapia génica. En este caso, se introdujo en el cuerpo del paciente una copia funcional del gen del factor de coagulación del gen defectuoso responsable de la hemofilia utilizando virus modificados genéticamente (por lo general virus adenoasociados (AAV)). Se estimula la traducción del gen dentro de las células endoteliales y sinusoidales del hígado utilizando un promotor para que, en el caso óptimo, el paciente pueda producir concentraciones suficientes de factor de coagulación. [5]
El control preciso y fiable del tratamiento de personas con hemofilia es de gran importancia para evitar las indeseables hemorragias y secuelas a largo plazo.
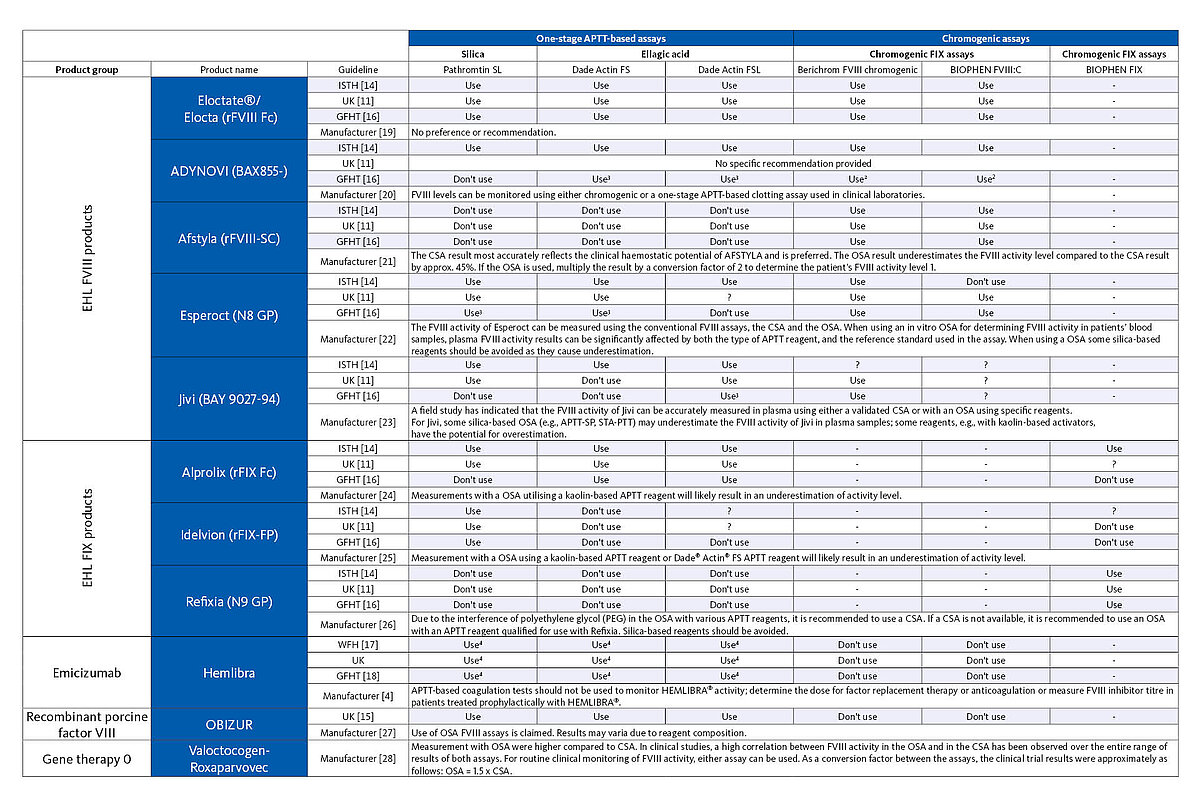
Para determinar los niveles de FVIII y FIX, se dispone de análisis de una o dos fases, así como de análisis cromogénicos (CSA). Son comúnmente conocidas las diferencias entre los resultados de los diversos análisis en hemofilia hereditaria, en particular sus formas leves. [6, 7, 8, 9, 10] Lo mismo ocurre con los resultados del control de tratamiento con concentrados de factor recombinante humano y productos recombinantes de longitud completa, aunque las pruebas de coagulación de una fase y las pruebas cromogénicas permiten esencialmente el control preciso del tratamiento. Con el desarrollo de nuevos productos recombinantes dotados de una semivida más larga y los tratamientos que se conocen como sin sustitución de factor, surgen nuevos retos para el laboratorio, dado que el laboratorio debería utilizar un análisis para el control del tratamiento, con resultados cercanos al valor de tratamiento basado en la ficha técnica.
Las diferencias entre los resultados de diferentes pruebas de factor basado en APTT de una fase (OSA) se atribuyen a diversos factores. Por consiguiente, la elección del reactivo de APTT para determinar la actividad del factor, es un factor. Los reactivos de APTT se diferencian por los fosfolípidos utilizados (de origen animal o vegetal o recombinante) y por sus concentraciones, además de por el activador elegido. Además, la elección del plasma deficiente en factor, por ejemplo, los plasmas con concentraciones de factor von Willebrand (FvW) con deficiencia de FVIII o el factor de actividad residual del plasma con deficiencia, también tienen una influencia crucial en la determinación de la concentración del factor en pacientes con hemofilia. Otros factores que pueden influir en la calidad del control del tratamiento de la hemofilia son la elección del calibrador, con recomendación a veces de calibradores específicos para el análisis, el analizador y los protocolos de test (análisis monodilución o multidilución y linealidad de la prueba). [10, 11, 12]
Como se ha mencionado anteriormente, existen discrepancias entre los OSA y los CSA en la determinación de la actividad del factor cuando este se determina mediante estos dos métodos, en pacientes con hemofilia leve. [6, 7, 8, 9, 10] En general, los resultados obtenidos con los OSA son más altos que los obtenidos con los CSA, siendo la diferencia más notable en pacientes con hemofilia leve. No obstante, lo contrario también puede ser cierto, que el resultado cromogénico corresponda a hemofilia leve, pero el cuadro clínico indique lo contrario. [13]
Otro factor de control del tratamiento de la hemofilia que no hay que descuidar es el propio medicamento. No se recomienda para algunos medicamentos con semivida larga y OSA porque subestiman la actividad del factor. Para otros medicamentos, este límite solo se aplica al activador utilizado por el reactivo de APTT. Por ejemplo, cuando se determina la concentración de FVIII infundido de Esperoct (N8 GP), no deben utilizarse la mayoría de los reactivos de APTT con base de sílice porque cuando se utiliza este reactivo se subestima la concentración de FVIII, algo que no ocurre con otros reactivos de APTT no basados en sílice. No obstante, cabe observar que las directrices individuales también excluyen del control del tratamiento con Esperoct a algunos reactivos de APTT no basados en sílice. En el caso de otros productos recombinantes, la elección del método de análisis no es importante, dado que se pueden medir con precisión tanto con OSA como con CSA.
Son tantos los enfoques terapéuticos diferentes que es importante que el laboratorio sepa qué medicamento ha estado recibiendo el paciente con hemofilia para poder elegir el método de medición más adecuado para el control del tratamiento. La siguiente tabla ofrece una descripción general de los sistemas de pruebas que se deben utilizar para el control terapéutico de las diferentes opciones terapéuticas según las instrucciones del fabricante y la opinión de expertos.
1 Algunas guías no lo recomiendan
2 Se recomienda un calibrador específico para el producto
3 Resultados discrepantes entre los estudios; la guía recomienda el uso de análisis cromogénicos y hay que interpretar los resultados con precaución o compararlos con los resultados del análisis cromogénico si se determina un análisis de factor basado en APTT de un paso.
4 Uso de un protocolo de análisis modificado con una mayor dilución de la muestra y un calibrador específico para Emicizumab
? Ni se recomienda específicamente ni se excluye
Bibliografía
[1] Schramm W. (2014): The history of haemophilia - a short review. Thromb Res. 2014 Nov;134 Suppl 1: S4-9.
[2] Franchini M, Mannucci PM. (2014): The history of hemophilia. Semin Thromb Hemost. 2014 Jul;40(5):571-6.
[3] Young G, Mahlangu JN. (2016): Extended half-life clotting factor concentrates: results from published clinical trials. 2016 Jul;22 Suppl 5:25-30.
[4] Hemlibra® (2022): Leitfaden für medizinisches Fachpersonal, Version 3.0, Stand: Dezember 2022. Roche Pharma AG.
[5] ROCTAVIAN (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[6] Bowyer AE, Van Veen JJ, Goodeve AC, Kitchen S, MakrisM. (2013): Specific and global coagulation assays in the diagnosis of discrepant mild hemophilia A. Haematologica 2013;98(12):1980–1987
[7] Baig MA, Swamy KB. (2021): Comparative analysis of chromogenic vs clot-based one stage APTT assay for determination of factor VIII level. Indian J Pathol Microbiol. 2021 Jan-Mar;64(1):123-127.
[8] Potgieter, J.J., Damgaard, M. and Hillarp, A. (2015): One-stage vs. chromogenic assays in haemophilia A. Eur J Haematol, 94: 38-44.
[9] Annette E. Bowyer, Robert C. Gosselin. (2022): Factor VIII and Factor IX Activity Measurements for Hemophilia Diagnosis and Related Treatments. Semin Thromb Hemost, available online at DOI: 10.1055/s-0042-1758870.
[10] Pouplard C, Trossaert M, Le Querrec A, et al. (2009): Influence of source of phospholipids for APTT- based factor IX assays and potential consequences for the diagnosis of mild haemophilia B. Haemophilia. 2009;15(1):365-368.
[11] Gray E, Kitchen S, Bowyer A, et al. (2020): Laboratory measurement of factor replacement therapies in the treatment of congenital haemophilia: A United Kingdom Haemophilia Centre Doctors’ Organisation guideline. Haemophilia. 2020; 26:6–16.
[12] Nougier C, Sobas F, Nguyen TK, et al. (2011): Analytic variability due to change of deficient plasma vials: application to one-stage clotting factor VIII assay. Blood Coagul Fibrinolysis 2011;22: 151–154.
[13] Bowyer AE, Goodeve A, Liesner R,Mumford AD, Kitchen S, Makris M. (2011): p.Tyr365Cys change in factor VIII: haemophilia A, but not as we know it. Br J Haematol 2011;154(5):618–625.
[14] Peyvandi F, et al. (2020): Laboratory testing in hemophilia: Impact of factor and non-factor replacement therapy on coagulation assays. J Thromb Haemost.; 18: 1242–1255.
[15] Bowyer A, Gray E, Lowe A, et al. (2022): Laboratory coagulation tests and recombinant porcine factor VIII: A United Kingdom Haemophilia Centre Doctors’ Organisation guideline. Haemophilia. 2022;1-5.
[16] Jeanpierre E, Pouplard C, Lasne D, et al; On behalf of the French Study Group on the Biology of Hemorrhagic Diseases (the BIMHO group). (2020): Factor VIII and IX assays for post-infusion monitoring in hemophilia patients: Guidelines from the French BIMHO group (GFHT). Eur J Haematol. 2020; 105:103–115.
[17] Srivastava A, et al. (2020): WFH Guidelines for the Management of Hemophilia, 3rd edition. Haemophilia: 26 (Suppl 6): 1 – 158.
[18] Nougier C, et al. (2020): Emicizumab treatment: Impact on coagulation tests and biological monitoring of haemostasis according to clinical situations (BIMHO group proposals). Eur J Haematol.; 105: 675–681.
[19] Elocta (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[20] ADYNOVI (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[21] AFSTYLA (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[22] Esperoct (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[23] Jivi (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[24] Alprolix (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[25] Idelvion (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[26] Refixia (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[27] OBIZUR (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.
[28] Valoctocogen-Roxaparvovec (2023): SUMMARY OF PRODUCT CHARACTERISTICS. Retrieved from EMA, 26 June 2023.