Calendario científico junio de 2022
Los hemoderivados leucorreducidos aseguran la seguridad en la transfusión
¿Qué fines persigue la leucorreducción de los concentrados de hematíes?
Aumentar su vida útil
Reducir efectos adversos de transfusión y la transmisión de enfermedades infecciosas
Reducir faltas de coincidencia entre grupos sanguíneos
Recoger hematíes para transfusión
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Fundamentación científica
Las transfusiones de sangre completa y las aféresis pueden salvar vidas, y se hacen muy necesarias en el día a día a nivel global. La donación, producción y transfusión de hemoderivados es un procedimiento complejo que debe seguir normas de calidad muy exigentes para preservar la salud tanto de donantes como de receptores.
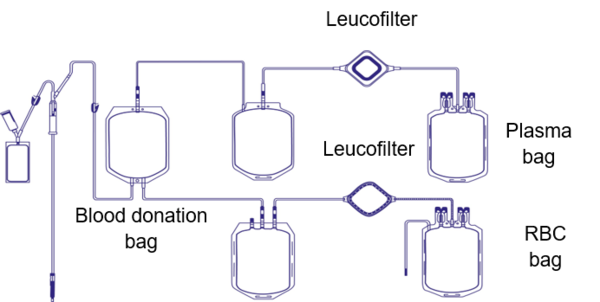
Es necesario llevar a cabo una diversidad de procedimientos hasta que sea posible administrar una transfusión de sangre completa o aféresis al paciente que la necesita. Los hemoderivados pueden ser concentrados de plasma, concentrados de hematíes o concentrados de plaquetas, procedentes de la separación de una donación de sangre completa o de aféresis (un procedimiento especial por el que se recoge solo el componente que interesa).
Uno de los pasos de elaboración se denomina «leucorreducción» o «leucodepleción», y se destina a limitar al mínimo la presencia de leucocitos del donante en el componente sanguíneo. La intención de fondo es reducir las reacciones transfusionales no febriles no hemolíticas o la enfermedad de injerto contra el hospedador (GvHD, por sus siglas en inglés), así como prevenir la aloinmunización HLA o la transmisión de patógenos como el citomegalovirus (CMV) [1].
Hacia fines de los 90 y con el cambio de siglo, la mayoría de los países desarrollados establecieron un paso de leucorreducción como procedimiento canónico durante la producción de componentes sanguíneos. No obstante, dependiendo de la guía, pueden encontrarse umbrales distintos en cuanto al control de calidad del paso de leucorreducción. La directiva de la UE establece que más del 90 % de los componentes sanguíneos probados deben contener menos de 1 x 106 de leucocitos residuales por unidad para ser idóneos para la administración a pacientes [2]. Los leucocitos se retiran con un filtro que suele estar unido a la bolsa de sangre empleada en la extracción.
Para controlar la eficacia del paso de leucorreducción, se evalúa el contenido en leucocitos residuales en muestras de las donaciones. Asimismo, se suele también comprobar la presencia de hematíes residuales (en concentrados de plasma y de plaquetas). Mientras que la razón principal de la leucorreducción es prevenir que ocurran efectos adversos por transfusión, como la transmisión de microorganismos que vivan en los leucocitos, o la aparición de reacciones febriles a la transfusión, en el caso de los hematíes se persigue reducir posibles efectos secundarios negativos por falta de coincidencia del grupo sanguíneo [3].
Recientemente, la transfusión de unidades de sangre completa leucorreducidas ha sido objeto de atención después de que un grupo de investigación canadiense demostrase que el crecimiento bacteriano en este tipo de unidades de sangre completa no pone en riesgo a los pacientes [4]. Este tipo de transfusión podría resultar especialmente útil para pacientes traumatológicos.
Interpretación del diagrama de dispersión
Información sobre casos de pacientes
Un paciente hospitalizado recibió varios concentrados de hematíes del banco de sangre del hospital durante un procedimiento quirúrgico. A pesar del buen resultado de la cirugía, el paciente desarrolló fiebre y signos de reacción inmune a las horas de concluir el procedimiento. Se extrajo y se analizó una muestra de sangre, que reveló leucocitosis, lo que confirmaba la sospecha de activación del sistema inmune.
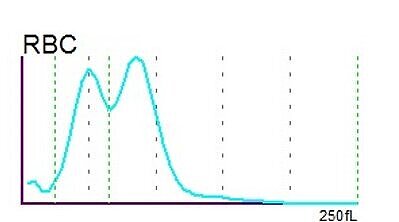
Interpretación del histograma y del diagrama de dispersión
El histograma de RBC de la Serie XN mostró un doble pico, lo que fue a continuación marcado por el analizador como «RBC Abn distribution» (distribución anómala de RBC) y «Dimorphic Population» (población dimórfica). El doble pico en el histograma es un fenómeno bastante frecuente que resulta de la presencia de dos poblaciones distintas de hematíes presentes en el paciente: la población propia y la adquirida a través de los concentrados de hematíes transfundidos.
Causa de fondo
Como el paciente no mostraba señales de infección ni inflamación en la zona de la herida, la explicación más probable sería la contaminación de los concentrados de hematíes administrados con leucocitos procedentes del donante.
Un inmunoensayo serológico confirmó la infección del paciente con (CMV), que suele vivir en los leucocitos. El paciente no tenía historial de infección por CMV, por lo que se concluyó que se había transferido el virus en uno de los concentrados de hematíes transfundidos. Se descubrió que el concentrado de hematíes respectivo estaba contaminado con hematíes del donante infectados con CMV.
Evaluación de la calidad de los hemoderivados
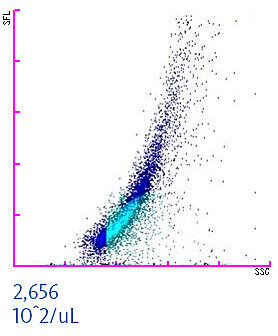
Para asegurar la calidad y seguridad de los concentrados de hematíes (o de otros compuestos sanguíneos elaborados) los resultados del proceso de leucorreducción se evalúan en los bancos de sangre. Al medir un componente sanguíneo leucorreducido en los analizadores de la Serie XN en modo Blood Bank (Banco de sangre), es posible cuantificar los leucocitos y hematíes residuales [3,5]. Ello ayuda a identificar unidades de transfusión contaminadas y mejorar la seguridad de las transfusiones. A continuación se muestra el diagrama de dispersión de un concentrado de hematíes contaminado por leucocitos. La concentración de hematíes residuales no debería superar el umbral de 1 x 106 hematíes por unidad. En el ejemplo inferior, la concentración es de 2656 x102/µL. Si se tiene en cuenta que una unidad de hematíes promedio tiene unos 250 mL, el personal de laboratorio identificaría la unidad descrita como contaminada y se desecharía para evitar perjudicar a algún paciente.
Bibliografía
[1] Mack S et al. (2020): Component residual white blood cell counting made easy? Transfusion, 60(1): 4 – 6. Free online: https://doi.org/10.1111/trf.15642
[2] European Directorate for the Quality of Medicines & HealthCare: Guide to the preparation, use and quality assurance of blood components. 19th ed. 2017, Council of Europe, Strasbourg, France.
[3] Cavagnetto C et al. (2020): Residual red cells in blood components: A multisite study of fully automated enumeration using a hematology analyzer. Transfusion, 61(2): 568 – 578. Free online: https://onlinelibrary.wiley.com/doi/full/10.1111/trf.16196
[4] Ramirez-Arcos S et al. (2022): Assessment of bacterial growth in leukoreduced cold-stored whole blood supports overnight hold at room temperature prior to filtration: A pilot study. Vox Sang. Online ahead of print.
[5] Lagerberg JW et al. (2020): Improved accuracy in counting residual white blood cells in red cell concentrates using new blood bank mode software of SYSMEX XN-1000 hematology analyzer. Transfusion, 60(10): 2456 – 2457.