Calendário científico de dezembro de 2022
Que testes laboratoriais devem ser realizados para diagnosticar LAD-III?
Avaliação da história clínica do doente, hemograma completo, testes de agregação plaquetária por agregometria por transmissão de luz (LTA), avaliação de glicoproteínas de plaquetas por citometria de fluxo e análise genética.
Testes de agregação plaquetária por agregometria por transmissão de luz (LTA), avaliação de glicoproteínas de plaquetas por citometria de fluxo e análise genética.
Hemograma completo, testes de agregação plaquetária por agregometria por transmissão de luz (LTA) e avaliação de glicoproteínas de plaquetas por citometria de fluxo.
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Deficiência de adesão leucocitária (LAD)
As síndromes de deficiência de adesão leucocitária (LAD) constituem um grupo de imunodeficiências primárias raras classificadas em três subtipos: LAD-I, LAD-II e LAD-III. Todas as três são caracterizadas por leucocitose acentuada, adesão leucocitária enfraquecida e infeções recorrentes. [1, 2, 3, 4]
A LAD é causada por um defeito genético que é herdado de maneira autossómica recessiva. A LAD-I é causada por mutações no gene ITGB2 (21q22.3), que codifica a integrina β2 CD18. [2, 5] A LAD-II é causada por uma mutação no gene SLC35C1 (11p11.2), que codifica o transportador de fucose guanosina 5'-difosfato (GDP), e a LAD-III resulta de uma mutação no gene FERMT3 (11q13.1), que codifica kindlin-3 de células hematopoiéticas. [5, 6, 7, 8, 9] Essas mutações resultam em adesão celular enfraquecida, o que leva, entre outras coisas, à migração celular restrita dos vasos para o local da infeção. [6, 7, 8, 9]
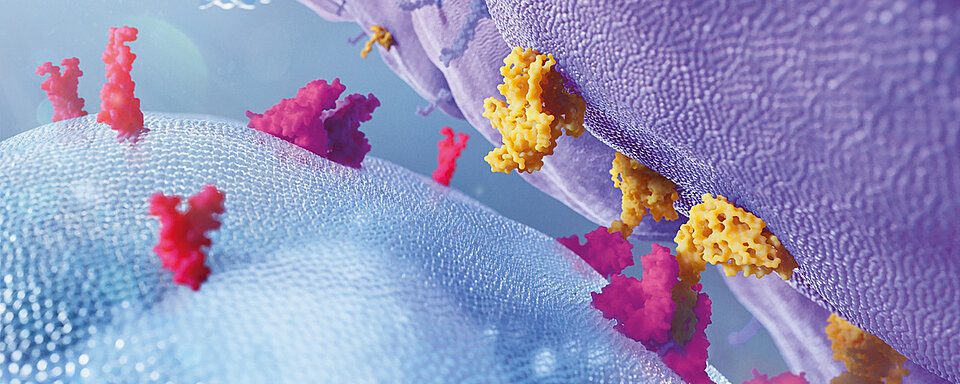
A cascata de adesão leucocitária
Em condições fisiológicas, a cascata de adesão leucocitária é iniciada com o aprisionamento e enrolamento de leucócitos no endotélio, seguida por ativação de leucócitos induzida por quimiocina, rolamento lento, adesão leucocitária firme e retenção, aumento da adesão por ligação de integrina, rastreamento e transmigração leucocitária.
Os principais atores moleculares envolvidos nos processos adesivos incluem selectinas e seus ligantes glicoproteicos, quimiocinas e seus receptores, integrinas e receptores de adesão da família das imunoglobulinas. α4- e β2-integrina desempenham um papel essencial no curso da cascata. A ativação da integrina ocorre após a sinalização desencadeada por quimiocina (sinalização de dentro para fora) em cooperação com vias ativadas por selectina. As integrinas ativadas contribuem para o enrolamento lento, a adesão firme, o rastreamento e a migração transendotelial. [10]
A mutação do gene ITGB2 (característica da LAD-I) causa a disfunção da integrina β2, que já não consegue cumprir sua função na cascata de adesão leucocitária.
Manifestação clínica dos diferentes subtipos de LAD
Os primeiros sintomas de LAD aparecem durante a infância ou na primeira infância. [5]
Os doentes com LAD-I com frequência apresentam infeções recorrentes (bacterianas ou fúngicas) potencialmente letais no sistema respiratório, pele e membranas mucosas. A ausência de sinais típicos de inflamação, como inchaço, vermelhidão ou formação de pus no local da infeção, é uma característica importante da LAD-I. Outras indicações da presença de LAD-I incluem o descolamento tardio do cordão umbilical (após o 14º dia de vida), que muitas vezes ocorre somente em relação com infeção do coto umbilical, e cicatrização de feridas retardada. [5, 11]
Mutações no gene SLC35C1 (11p11.2), que codifica o transportador de fucose guanosina-5'-difosfato (GDP) localizado no aparelho de Golgi, resultam no quadro clínico de LAD-II. Este transportador específico de fucose transloca a GDP-fucose do citosol para o aparelho de Golgi, onde é utilizado como substrato para a fucosilação. O transportador de açúcar defeituoso leva à glicosilação enfraquecida de ligantes de selectina, o que, por sua vez, leva ao comprometimento do recrutamento e enrolamento de leucócitos. Os doentes com LAD-II com frequência também apresentam infeções bacterianas recorrentes, mas estas são frequentemente menos severas do que aquelas observadas na LAD-I. A perda dentária precoce devido à periodontite severa, bem como défices intelectuais e atraso do crescimento caracterizam o quadro clínico. Os doentes com LAD-II não possuem os antigénios dos grupos sanguíneos H e Lewis Lea e Leb. [5, 9, 11]
A mutação no gene FERMT3 (11q13.1) em doentes com LAD-III resulta num defeito na ativação de todas as β-integrinas (β1, β2 e β3), mas expressão de integrina normal. Isso causa um quadro clínico idêntico ao dos doentes com LAD-I. Além disso, devido à disfunção da β3-integrina, as plaquetas são incapazes de aderir à parede do vaso, o que resulta em episódios hemorrágicos semelhantes aos de um doente com trombastenia de Glanzmann (GT). Estes doentes tendem a ter episódios hemorrágicos mais longos do que pessoas saudáveis e têm hemorragias nasais e gengivais mais frequentes, bem como hematomas. [4, 5, 6, 7, 8, 11] Menos de 40 casos de LAD-III foram notificados até agora. [12]
Diagnóstico de LAD e seus subtipos
O diagnóstico de LAD inclui o doente individual e antecedentes familiares, bem como o exame do hemograma, função plaquetária e glicoproteínas da superfície celular. Um diagnóstico final é sempre alcançado por análise genética. [13]
O diagnóstico de LAD-I é baseado num hemograma completo quantitativo com evidência de leucocitose neutrofílica. A expressão de β2-integrina diminuída (CD11, CD18) nos leucócitos é detetada por citometria de fluxo. A deteção de mutações ITGB2 confirma o diagnóstico. [13]
O diagnóstico de LAD-II é baseado em descobertas clínicas e num hemograma completo com evidência de leucocitose neutrofílica. O determinação do grupo sanguíneo é essencial para detetar o grupo sanguíneo Bombay, que está presente em todos os doentes com LAD-II, mas não muito frequentemente na população em geral. O diagnóstico final é baseado na deteção genética de mutações no gene SLC35C1 (11p11.2). [9, 13]
O diagnóstico de LAD-III é baseado em descobertas clínicas e em um hemograma completo com evidência de leucocitose neutrofílica. Testes de agregação plaquetária por agregometria de transmissão de luz (LTA) com utilização dos agonistas listados na Tabela 1 e análise de glicoproteínas de superfície por citometria de fluxo (ver Tabela 2) são utilizados para diagnóstico adicional. [13] A diferenciação entre GT quantitativo (tipo I e II) e LAD-III requer a quantificação da expressão da glicoproteína plaquetária por citometria de fluxo.
Tabela 1 Agregação plaquetária em LAD-III por agonista [14]
| Agonista | Resultado |
| Epinefrina | Agregação diminuída/ausente |
| ADP | Agregação diminuída/ausente |
| Colagénio | Agregação diminuída/ausente |
| α-trombina | Agregação diminuída/ausente |
| TRAP6 | Agregação diminuída/ausente |
| U46619 | Agregação diminuída/ausente |
| CRP | Agregação diminuída/ausente |
| Convulxin | Agregação diminuída/ausente |
| PAR-4 ap | Agregação diminuída/ausente |
| PAF | Agregação diminuída/ausente |
| A23187 | Agregação diminuída/ausente |
| Ristocetina | Resposta normal |
Tabela 2 Deteção de glicoproteínas em doentes LAD-III por citometria de fluxo
| Glicoproteína | Resultado |
| Expressão de GPIIb (CD41) | Normal |
| Expressão de GPIIIa (CD61) | Normal |
| Epítopo de ativação GPIIb/IIIa (PAC-1) | Ativação defeituosa |
Em doentes com LAD-III, o diagnóstico final é obtido pela deteção genética da mutação no gene FERMT3 (11q13.1). [13, 14, 15]
Opções terapêuticas
O tratamento dos doentes é limitado principalmente ao controle das infeções com antibióticos e antimicóticos. Os doentes com LAD-III também podem receber transfusões, se necessário. Atualmente, os doentes com LAD-I e LAD-III somente podem ser curados por transplante de células estaminais hematopoiéticas (transplante de medula óssea). A terapia génica pode ser uma nova opção terapêutica para doentes com LAD-I – estudos estão a ser realizados atualmente. [16, 17, 18] Em doentes com LAD-II, a resposta imunitária pode ser melhorada através da substituição da fucose. [19] Estes doentes normalmente têm uma esperança de vida consideravelmente maior do que os doentes com LAD-I e LAD-III..
Referências
[1] Etzioni A et al. (1992): Recurrent Severe Infections Caused by a Novel Leukocyte Adhesion Deficiency. N Engl J Med; 327: 1789–1792.
[2] Anderson DC, Springer TA. (1987): LEUKOCYTE ADHESION DEFICIENCY: An Inherited Defect in the Mac-I, LFA-l, and pI50,95 Glycoproteins. Ann Rev Med; 38: 175–194.
[3] Mathew EC, Shaw JM, Bonilla FA, Law SK, Wright DA. (2000): A novel point mutation in CD18 causing the expression of dysfunctional CD11/CD18 leucocyte integrins in a patient with leucocyte adhesion deficiency (LAD). Clin Exp Immunol; 121: 133–138.
[4] Kuijpers TW et al. (1997): Leukocyte adhesion deficiency type 1 (LAD-1)/variant: a novel immunodeficiency syndrome characterized by dysfunctional β2 integrins. J Clin Invest; 100: 1725–1733.
[5] Hanna S, Etzioni A. (2012): Leukocyte adhesion deficiencies. Annals of the New York Academy of Sciences; 1250: 50–55.
[6] McDowall A et al. (2003): A novel form of integrin dysfunction involving β1, β2, and β3 integrins. J Clin Invest; 111: 51–60.
[7] Svensson L et al. (2009): Leukocyte adhesion deficiency-III is caused by mutations in KINDLIN3 affecting integrin activation. Nat Med; 15(3): 306–312.
[8] Meller J et al. (2012): Novel aspects of Kindlin-3 function in humans based on a new case of leukocyte adhesion deficiency III. J Thromb Haemost; 10: 1397–1408.
[9] Hidalgo A et al. (2003): Insights into leukocyte adhesion deficiency type 2 from a novel mutation in the GDP-fucose transporter gene. Blood; 101(5): 1705–1712.
[10] Mitroulis I et al. (2015): Leukocyte integrins: Role in leukocyte recruitment and as therapeutic targets in inflammatory disease. Pharmacol Ther; 147: 123–135.
[11] Harris ES, Weyrich AS, Zimmerman GA. (2013): Lessons from rare maladies: leukocyte adhesion deficiency syndromes. Curr Opin Hematol; 20(1): 16–25.
[12] Saultier P, Szepetowski S, Canault M et al. (2018): Long-term management of leukocyte adhesion deficiency type III without hematopoietic stem cell transplantation. Haematologica; 103(6): e264–e267.
[13] Etzioni A. (2007): Leukocyte Adhesion Deficiencies: Molecular Basis, Clinical Findings, and Therapeutic Options. In: Shurin MR, Smolkin YS. (eds.) Immune-Mediated Diseases. Advances in Experimental Medicine and Biology. Vol. 601; Springer, New York, NY.
[14] Gresele P for the Subcommittee on Platelet Physiology. (2015): Diagnosis of inherited platelet function disorders: guidance from the SSC of the ISTH. J Thromb Haemost; 13: 314–322.
[15] Manukjan G et al. (2020): Novel variants in FERMT3 and RASGRP2—Genetic linkage in Glanzmann-like bleeding disorders. Pediatr Blood Cancer; 67: e28078.
[16] Almarza E et al. (2019): Gene Therapy for Lad-I Immunodeficiency: Preclinical Evaluation of HSC Transduction Under Optimized GMP-Conditions. Blood; 134 (Supplement_1): 5751.
[17] Mesa-Núñez C et al. (2022): Preclinical safety and efficacy of lentiviral-mediated gene therapy for leukocyte adhesion deficiency type I. Molecular Therapy - Methods & Clinical Development; 26: 459–470.
[18] Kohn DB et al. (2021): A Phase 1/2 Study of Lentiviral-Mediated Ex-Vivo Gene Therapy for Pediatric Patients with Severe Leukocyte Adhesion Deficiency-I (LAD-I): Interim Results. Blood; 138 (Supplement_1): 2932.
[19] Marquardt T et al. (1999): Correction of Leukocyte Adhesion Deficiency Type II with Oral Fucose. Blood; 94(12): 3976–3985.